Tillverkande industri
Möt krav och kundernas förväntningar med en plattform som tar sig an branschens tuffa utmaningar...
Branscher & roller
Branscher
Det ska inte vara svårare än det behöver vara. Oavsett om det handlar om hygien i livsmedel eller effektivitet i produktionen, har vårt system lösningarna som gör ditt jobb enklare och tryggare. Och ja, du kommer undra hur du klarade dig utan dem.

Möt krav och kundernas förväntningar med en plattform som tar sig an branschens tuffa utmaningar...

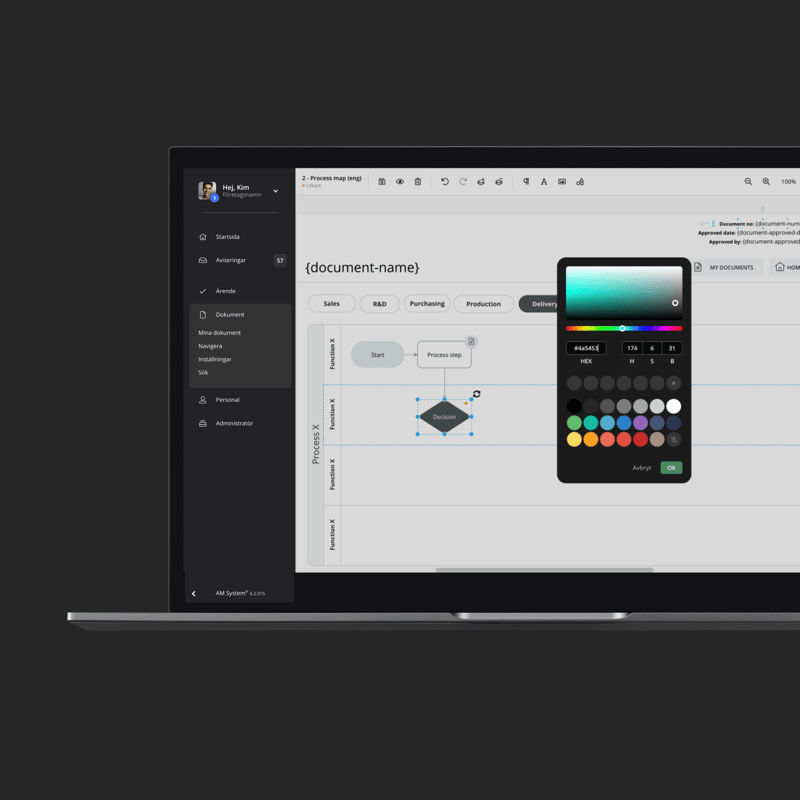
Från HACCP och FSSC 22000 till kvalitetskontroller och dokumentation – AM System hjälper er...
Roller
Din vardag kräver mer än bara verktyg. Därför har vi byggt ett ledningssystem som hjälper er fatta datadrivna beslut, möta krav och nå era mål – samtidigt som du involverar hela verksamheten. Det ska vara lätt att göra rätt.
Ledningsprocess. Riskanalyser. Policys. Oavsett vad så håller vårt system allt samlat och lättillgängligt, så att du kan fatta rätt och datadrivna beslut och hålla hela organisationen synkad.

Du som navigerar ISO-standarder, engagerar processägare, och hanterar avvikelser – se hit. Vårt ledningssystem hjälper dig möta krav och leverera kvalitet som du, och hela organisationen, kan stå bakom.

Trygg arbetsmiljö börjar med struktur. Hantera allt från utbildningsregister och rollbeskrivningar till medarbetarundersökningar och skyddsronder – allt anpassat för att stödja dig och din organisation.

Bygg din egna leverantörsportal. Samla allt från leverantörsbedömningar och produktgodkännanden till reklamationer och certifikatstatus på ett ställe – överskådligt och transparent. Perfekt för att hålla kvalité och kostnader i schack.

En vardag fylld av korta deadlines kräver stöd som gör skillnad. AM System hjälper produktionspersonalen att veta vad som ska göras och ger produktionsledningen verktyg att prioritera rätt, inkludera teamet och samla in data – för en smidig och effektiv produktion.

























Effektivitet, kvalitet och trygghet på samma ställe. Med AM System hanterar du industrins krav, standarder och utmaningar utan på ett enkelt sätt.

AM System är utvecklat för att möra industrins höga krav på ett tillgängligt och användarvänligt sätt. Och med datadriven precision blir det enkelt att agera snabbt, effektivt och självsäkert.

Team
Hos AM System handlar allt om att förstå dina utmaningar och ge dig rätt stöd. Våra experter har lång erfarenhet av tillverkande industri och ledningssystem där vardagen handlat om att skapa struktur och styrning i hela organisationen. Med andra ord, vi förstår dig och dina utmaningar. Vår drivkraft är att du ska få ut maximalt värde av vårt ledningssystem.

Customer Success Manager

Customer Success Manager
Boka demo